2023年9月11日,上海师范大学生命科学学院刘竞男副研究员与上海科技大学刘冀珑团队合作在eLife在线发表了题为“Fat body-specific reduction of CTPS alleviates HFD-induced obesity”的研究论文。同时,该论文被遴选为“eLife digest”特别撰文报道。该研究揭示了脂肪组织中CTP合成酶(CTPS)动态聚合或解聚在脂质生成和脂肪组织发育过程中的重要作用。通过整合PI3K-AKT信号通路,CTPS能感应营养变化并调整代谢适应能力,从而影响脂质合成基因表达,调控脂代谢稳态的生理功能和分子机制。

肥胖是全球性流行的代谢疾病,其特征是脂肪堆积过多或异常。肥胖是糖尿病、心血管疾病和癌症等慢性疾病的主要风险因素,每年约有250万人死亡,对健康构成很大威胁。高脂肪饮食(HFD)是导致肥胖的主要因素,了解肥胖及其相关的继发性疾病的机制需要综合考虑遗传因素和过量饮食脂肪摄入的有害影响。然而,遗传易感性、环境和生活方式因素在肥胖病因中的确切相互作用仍有待阐明。面对高脂诱导的肥胖、糖尿病和心血管疾病等代谢性疾病,果蝇以其丰富的遗传工具,生命周期较短的优势成为研究遗传学、饮食和代谢之间联系的一个强大而简化的理想动物模型。作者在前期研究中利用荧光标签敲入果蝇,通过超高分辨显微成像发现脂肪细胞中CTPS作为与胶原蛋白 IV—整合蛋白通路(Collage IV-integrins)相互作用的蛋白分子,通过分子的聚合和解聚,调控粘连蛋白和胶原蛋白在细胞中的分布(图1),在脂肪细胞连接和组织构建中发挥关键的调节功能和作用(Jingnan Liu, et al.,Cellular and Molecular Life Science2022)。脂肪组织是机体调控脂质和能量代谢的重要器官,CTPS是否直接参与脂代谢稳态调节?通过何种下游分子或通路影响细胞稳态?成为亟待回答的重要科学问题。
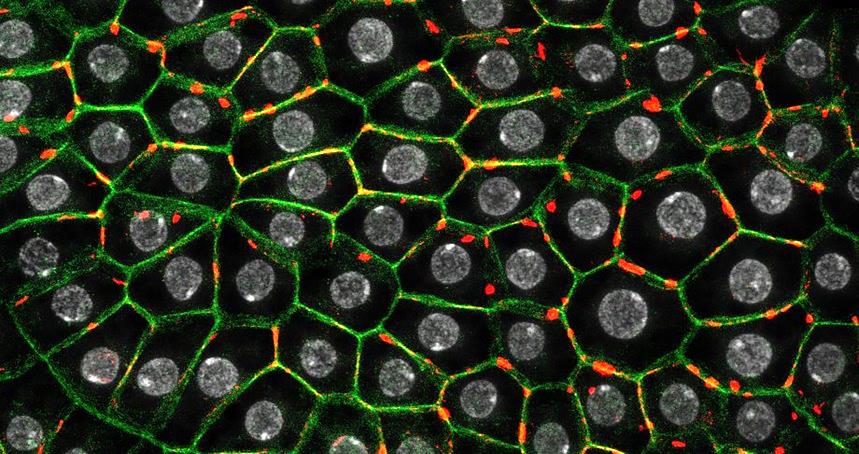
图1. 脂肪细胞中CTPS聚合物紧邻细胞膜分布(CTPS,红色;脂肪细胞,绿色;细胞核,灰白色)
该研究中,作者首先利用UAS/GAL4系统在果蝇成虫神经组织和脂肪组织等重要的代谢组织中,分别特异性地敲低CTPS表达。研究发现CTPS在果蝇脂肪体中参与体重和饥饿耐受的代谢调节。进一步研究发现在高脂饮食下,伴随着果蝇增重和脂质堆积的增加,脂肪体中CTPS表达增强,随之形成的聚合体长度增加,提示CTPS能够通过动态分子组装以响应营养变化。深入研究发现脂肪组织特异敲低CTPS表达能显著降低幼虫体重和脂肪积累,表现为脂肪细胞和细胞核减小,重要的能量存储分子甘油三脂(TAG)含量明显减少(图2)。

图2. CTPS缺失抑制高脂诱导的体重增加和脂质积累
通过构建H355A点突变特异破坏脂肪细胞中CTPS分子聚合,研究发现CTPS聚合缺失的果蝇在高脂饮食下,体重和脂质积累明显少于野生型果蝇。结合靶向脂质组学和RNA-Seq分析,发现CTPS缺失导致脂肪细胞膜PI3K活性降低, 抑制AKT 的磷酸化水平,进而抑制关键脂质合成酶Acc和FASN1的基因表达。这一发现揭示了CTPS细胞蛇缺失抑制高脂饮食诱导的脂质堆积的分子机制,同时阐明了CTPS通过PI3K-AKT通路在脂质生成和调控脂肪细胞脂质平衡中扮演至关重要的角色。
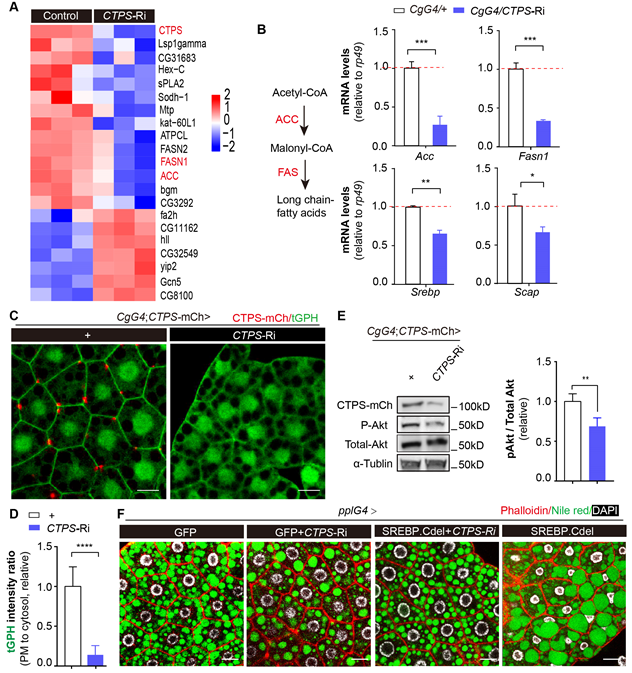
图3. CTPS缺失通过抑制PI3K-AKT-SREBP通路活性抑制脂质合成酶Acc和FASN1的基因表达,从而调节脂质生成和代谢稳态
研究不仅阐明CTPS动态组装在调控果蝇响应生长发育和外界营养变化的能量利用方面的作用,还揭示了其与PI3K-AKT信号通路协调控制脂质代谢的生理功能和分子机制(图4)。该研究增进了我们对于哺乳动物和人类CTPS在脂质代谢中的生理功能的理解,并为治疗人类相关代谢疾病提供了新的干预靶点。该研究得到了国家自然科学基金和国家重点研发项目的资助。
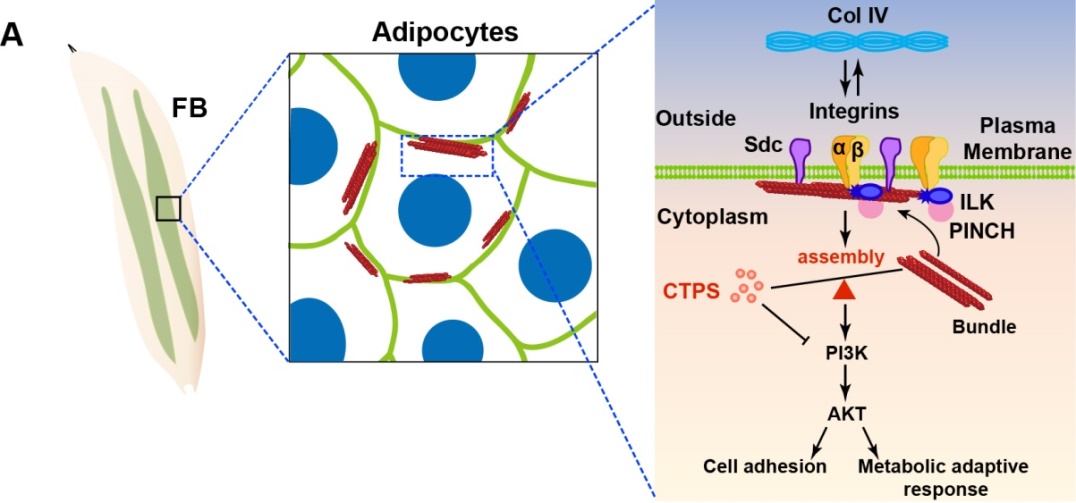
图4. 脂肪细胞中CTPS 整合PI3K-AKT通路调控脂肪生成和代谢适应的模型。
论文链接:https://elifesciences.org/articles/85293
供稿:刘竞男
责任编辑:陈婉娴


